Según ese documento, el Departamento de Regulación, Vigilancia y Control de la Salud y el Departamento de Regulación y Control de Productos Farmacéuticos y Afines podrán aprobar la comercialización de vacunas contra el covid-19 durante un año por ser de carácter de urgencia en el contexto de la pandemia.
Para obtener la autorización, según ese documento, los importadores deberán respaldar que las vacunas cuentan con el aval de organismos como la OMS, la FDA o EMA. Tiene la firma y sello de Leslie Lorena Samayoa Jerez de Hermosilla, jefa del Departamento de Regulación y Control de Productos Farmacéuticos y Afines, y de Mirna Floridalma Tellez Orellana, directora de Regulación, Vigilancia y Control de la Salud.

Respuesta escueta
Durante la mañana de este 16 de marzo, Salud dijo en Twitter que ese documento “no fue emitido ni aprobado por ninguna autoridad del Ministerio de Salud”, sin ampliar detalles ni calificarlo como falso.
⚠️ ATENCIÓN ⚠️
Informamos que este documento que circula en distintas redes sociales no fue emitido ni aprobado por ninguna autoridad del Ministerio de Salud Pública y Asistencia Social. pic.twitter.com/jQ4d3Ud8Cl
— Ministerio de Salud Pública (@MinSaludGuate) March 16, 2021
De hecho, al googlear “Norma Técnica 86-2021, Normativa para Autorización y Distribución de Vacunas Covid-19 para Uso de Emergencia”, el buscador dirige hacia la página web del Ministerio de Salud y el Departamento de Regulación y Control de Productos Farmacéuticos y Afines, pero no se encuentra aquel documento porque ahora la página requiere de un usuario y una contraseña para acceder a él.
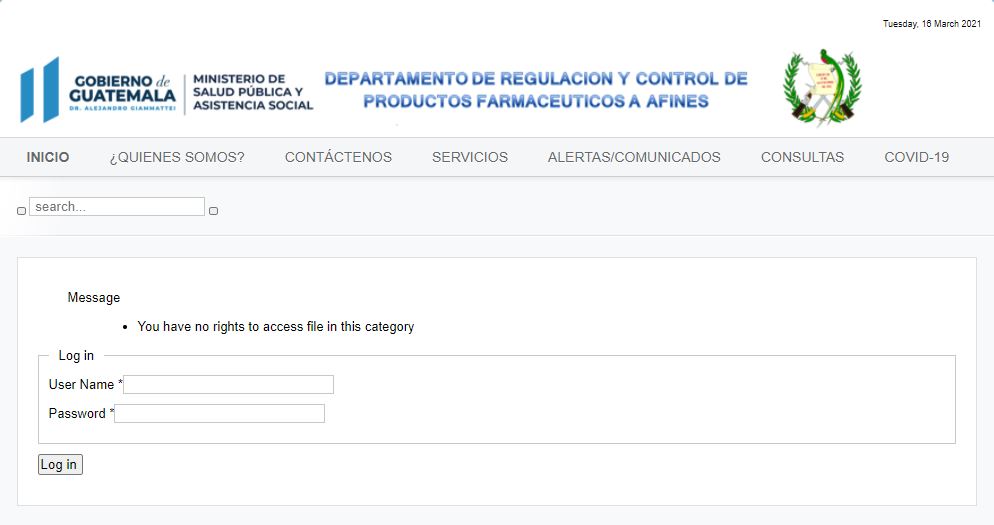
El ministerio no respondió las dudas sobre por qué este documento estaba colgado en su página web si no estaba aprobado y por qué ahora no puede verse.
Siga leyendo | Contagios de covid-19 en escuelas divide criterios de sindicalistas y el Mineduc
En ese mismo sentido, la Intendencia de Aduanas de la Superintendencia de Administración Tributaria (SAT) comunicó en un boletín electrónico aduanero del 11 de marzo de 2021 que aquella norma técnica “ha sido retirada temporalmente de la página web de Salud hasta nueva orden” y remitió las consultas del caso a Salud.

La oficina de comunicación de la SAT confirmó este 16 de marzo que la normativa se dio de baja en el portal de Salud y, de la misma forma que el boletín, dijo que el ministerio debe responder las consultas sobre el motivo.
Al momento de la publicación de esta nota, Salud no había ampliado su declaración en torno al documento en mención o si adoptará alguna disposición en torno a la vacuna.
Dentro de un anexo del Plan Nacional de Vacunación contra el Covid-19, Mario Melgar, presidente del Consejo Nacional Asesor de Prácticas de Inmunización (Conapi), recomienda que se regule “la importación de vacunas para el sector privado, para garantizar únicamente el uso de vacunas eficaces y seguras en Guatemala”.
Hasta ahora, solo el Ejecutivo ha gestionado por Guatemala las vacunas contra el virus. Se han recibido 286 mil 600 dosis -200 mil de Covishield, del laboratorio AstraZeneca y fabricadas y donadas por India; cinco mil de Moderna donadas por Israel y 81 mil 600 de AstraZeneca a través del mecanismo Covax- y, según reporte oficial del 12 de marzo, ya se había inyectado a 19 mil 947 personas con la primera dosis.
Las vacunas existentes permitirán, según Salud, inmunizar a todo el personal de primera línea contra el covid-19 -118 mil 972-, y avanzar hacia la segunda fase -24 mil 328 personas-.
Pero en ese contexto han surgido contingencias asociadas a la vacuna de AstraZeneca -de las cuales Guatemala ha recibido 205 mil- y que varios países europeos han suspendido su uso, como Noruega, Islandia Dinamarca, Estonia, Lituania y Luxemburgo. Al respecto la EMA aseguró hoy que “no hay pruebas” de supuestos efectos negativos de la vacuna anticovid de AstraZeneca y sigue “convencida” de sus beneficios.
Guatemala dice que el Programa de Farmacovigilancia ha hecho monitoreos, pero no ha encontrado casos de reacciones adversas graves relacionadas con la vacuna y que si llegara a ocurrir algo sospechoso se convocará a un panel de especialistas para investigar y establecer la causalidad entre la vacuna y la reacción, por lo que su uso continúa.